Сегодня они стали необходимым реагентом в биологических лабораториях. Продажи препаратов, в которых встречаются моноклональные антитела, направленные на терапию тяжелейших заболеваний (псориаз, рак, артрит, склероз), имеют многомиллиардный оборот. Хотя в 1975 году, когда была опубликована статья про метод получения гибридом, лишь единицы поверили в их практическое применение.
Содержание
- 1 Что такое моноклональные антитела
- 2 Получение моноклональных антител
- 3 Применение
- 4 Принцип лечения
- 5 Препараты с моноклональными антителами
- 6 Чудо генной инженерии — человеческие моноклональные антитела
- 7 История открытия
- 8 Разработка новых моноклональных антител сегодня
- 9 Номенклатура моноклональных антител
- 10 Система разработки моноклональных антител
- 11 Механизм действия
- 12 Сфера применения и стоимость
- 13 Применение МАТ при ревматоидном артрите
Что такое моноклональные антитела
Они вырабатываются иммунными клетками, происходящими от одной предшественницы, принадлежащими к одному клону. Это явление наблюдается при выращивании В-лимфоцитов в культуре. Такие антитела могут вырабатываться против почти любого природного антигена (к примеру, бороться с чужеродным белком и полисахаридами), который они будут специфически связывать. Далее они используются для обнаружения этого вещества или его очистки. Моноклоны широко применяются в биохимии, молекулярной биологии, медицине. Производить антитела нелегко, что напрямую влияет на их стоимость.
Получение моноклональных антител
Этот процесс начинается с иммунизации животных, как правило, мышей. Для этого вводят специфический антиген, который синтезирует антитела против него. Затем у мыши удаляется селезенка и гомогенизируется для получения суспензии клеток. Она содержит B-клетки, продуцирующее антитело. Затем их смешивают с миеломой (мышиной плазмоцитомы), которая имеет непрерывную способность синтезировать себе подобных в культуре (опухолевые клоны).
Благодаря слиянию образуются гибриды опухолевых и нормальных клеток (гибридомы), непрерывно растущие и способные производить смесь антител заданной специфичности. Следующий шаг после получения гибридом — клонирование и отбор. В каждую лунку специального планшета помещают около 10 слитых клеток и культивируют их, проверяя на выработку специфических иммуноглобулинов. Гибридомы из лунок, содержащих нужные идентичные антитела (парапротеины), клонируют и вновь проверяют. Так делают 1-2 раза.
В результате получают клетки, способные производить собственные иммуноглобулины только одной нужной уникальной специфичности. Далее клоны можно заморозить и сохранять. Или же культивировать, накапливать, привить мышам, где они также будут расти. Впоследствии полученные молекулы иммуноглобулина разными методами очищаются от посторонних примесей и используются для диагностики в лабораториях или терапевтического применения.
Важно отметить, что полученный с помощью гибридомы клеточный клон является мышиным иммуноглобулином, который при попадании в организм человека вызовет реакцию отторжения. Выход нашли благодаря рекомбинантным технологиям. Взяв фрагмент мышиного моноклона, соединили его с фрагментом человеческого иммуноглобулина. В результате были получены гибридомы, получившие название химерных, которые были уже более близкими для человека, но все равно провоцировали иммунные реакции организма, отличающиеся от требуемых.
Следующий шаг был сделан благодаря генной инженерии и связан с созданием, так называемых гуманизированных антител, на 90% гомологичных человеческому иммуноглобулину. От первоначального гибридомного мышиного моноклона осталась лишь маленькая часть от слияния клеток, которые отвечают за специфическое связывание. Они и используются в клинических испытаниях.
Применение
Моноклоны успешно вытесняют иммунные сыворотки. Гибридомы создали удивительные возможности в аналитике: их применяют как «микроскоп» с необычайно высоким разрешением. С их помощью можно обнаружить уникальные антигены, характерные для раковых клеток конкретных тканей, получить к ним моноклоны определенной специфичности и использовать для диагностики и типирования новообразований. Применяют их еще при лечении псориаза, рассеянного склероза, артритов, болезни Крона, раке молочной железы и многих других.
При псориазе
Для терапии псориаза тяжелых форм назначают прием системных глюкокортикостероидов (стероидные гормоны), влияющих на гормональный фон человека и подавляющих местный иммунитет. Моноклональные антитела при псориазе воздействуют исключительно на активные клетки псориатического воспаления, не подавляя иммунную систему полностью. Терапевтический эффект – снижение активности воспаления, нормализация деления клеток кожи и исчезновение псориазных бляшек.
При ревматоидном артрите
Моноклональные антитела при ревматоидном артрите оказались эффективны в тех ситуациях, где другие средства не оказали лечебного действия. В европейских странах сегодня основным терапевтическим направлением при этом недуге являются такие препараты. Терапевтический курс длительный по времени, ведь лекарства действуют хоть и эффективно, но медленно. Из-за сложностей в диагностике артритов за лечебной помощью стоит обращаться как можно раньше, при первых же симптомах и подозрениях.
Для лечения рака
Для большого числа пациентов с онкологией фармпрепараты, в составе которых содержатся моноклоны, стали надеждой на выздоровление и возврат к нормальной жизни. Многие люди с крупными злокачественными опухолями тела, множеством опухолевых клеток и малоутешительными прогнозами после курса терапии почувствовала улучшение состояния. Моноклональные антитела для лечения рака имеют очевидные преимущества:
- Прикрепляясь к злокачественным клеткам, они не только делают их более заметными, но и ослабляют, нарушают их структуру. С ними человеческому организму бороться гораздо легче.
- Обнаружив свою цель, они способствуют блокировке рецепторов роста опухоли.
- Разработка антитела осуществляется в условиях лабораторий, где они намеренно соединяются с малым количеством радиоактивных частиц. Перенося эти частицы по организму, они доставляют их прямо к опухоли, где те и начинают действовать.
Принцип лечения
Действие моноклонов простое: они распознают определенные антигены и связываются с ними. Благодаря этому иммунная система быстро замечает проблему и вступает с ней в борьбу. Они помогают организму человека самостоятельно справиться с антигенами. Еще одно их огромное преимущество – воздействие исключительно на патологически измененные клетки, не нанося при этом вреда здоровым.

Препараты с моноклональными антителами
Хотя изобретены гибриды нормальных и опухолевых клеток такого типа были не очень давно, спектр препаратов, содержащих их в своем составе, уже выглядит внушительно. Новинки фармацевтики появляются регулярно. Такие препараты, как и большинство лекарственных средств, имеют различные побочные эффекты. Нередко после применения моноклональных веществ поступают жалобы на проявление аллергических реакций в виде зуда, сыпи. Изредка терапия сопровождается тошнотой, рвотой или кишечным расстройством. Далее об эффективных препаратах подробнее.
Стелара
Используется при терапии тяжелых форм бляшечного псориаза. Фармпрепарат состоит из моноклонов человека, что сводит риск возникновения побочных эффектов к минимуму. Форма выпуска – раствор для подкожного введения во флаконе или в шприце. Рекомендованная дозировка составляет 45 мг в сутки. Вторую инъекцию вводят через 4 недели после первой, далее уколы делают 1 раз в 12 недель. Терапевтический эффект от Стелара проявится уже через 15-20 дней. Поддерживающее лечение обеспечивает продолжительность ремиссии. После 2 инъекций кожа очищается на 75%.
Ремикейд
Представляет собой химерные антитела на основе моноклонов мыши и человека. Препарат снижает воспаление эпидермиса, регулирует деление кожных клеток. Форма выпуска – порошок лиофилизированный для приготовления парентерального раствора или во флаконах 20 мл. Состав для инфузий вводят внутривенно на протяжении 2-х часов со скоростью до 2 мл в минуту. Дозировка зависит от степени тяжести болезни. Повторные инъекции делают через 2 и 6 недель после первой. Для поддержки эффекта терапию повторяют каждые 1,5-2 месяца.
Хумира
Рекомбинантный моноклон с пептидной последовательностью, идентичной человеческой. Препарат эффективен при терапии сложных форм псориаза, тяжелом активном ревматоидном и псориатическом артрите. Применяется в виде подкожных инъекций в область живота или переднюю бедренную поверхность. Форма выпуска – раствор для подкожного введения. Уколы по 40 мг вводятся 1 раз в 2 недели.
Симпони
Составляющие фармпрепарата — моноклоны человека. Применяется при прогрессирующем псориатическом или ревматоидном артрите, анкилозирующем спондилите. Это средство помогает уменьшить симптомы при псориазе ногтей и кожи. Форма выпуска – раствор для подкожных инъекций (шприц или автоинжектор). Симпони требуется вводить подкожно один раз в месяц.
Роза Ягудина о значении моноклональных антител в современной медицине и перспективах их применения
Чудо генной инженерии — человеческие моноклональные антитела
Моноклональные антитела (МАТ) сегодня применяются при лечении заболеваний, большинство из которых еще несколько десятков лет назад считались неизлечимыми. Это онкологические, аутоиммунные, сердечно-сосудистые и инфекционные заболевания, воспалительные реакции различного генеза, системный склероз, идиопатический фиброз легких, гепатит В, СПИД, ревматоидный артрит, системная красная волчанка, аллергические реакции, мышечная дистрофия, болезнь Альцгеймера, астма, диабет и другие заболевания.
Препараты, изготовленные на основе моноклональных антител, относятся к новейшим в современной медицине. С середины 90-х годов до сегодняшнего дня на мировом фармацевтическом рынке одобрено более 30 лекарственных средств, имеющих в составе моноклональные антитела. Первоначально надежность методов и технологий производства моноклональных антител и безопасность их применения вызывали опасения у фармацевтических производителей. Однако сегодня научный и медицинский опыт показал возможность их эффективного и безопасного применения в медицине. Сейчас большинство фармацевтических компаний работают над разработкой новых препаратов и лекарственных средств на основе моноклональных антител. На этапе разработки в мире находится около 300 МАТ.
В чем же уникальность и специфика применения моноклональных антител?
Роза Исмаиловна Ягудина , доктор фармацевтических наук, профессор, зав. кафедрой организации лекарственного обеспечения и фармакоэкономики, зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова, г. Москва, главный редактор журналов «Фармакоэкономика» и «Современная организация лекарственного обеспечения».
Иллюстрации и примеры в статье взяты из: Ягудина Р.И., Тихомирова А.В. История развития моноклональных антител, их настоящее и будущее // Современная организация лекарственного обеспечения. – 2013. – №1. – 6–27
История открытия
История получения и применения моноклональных антител уходит своими корнями в исследования конца 19 века. С тех пор, за прошедшие более чем сто лет, моноклональные антитела успели несколько раз совершить революцию в медицине, полностью перевернув представления о возможностях лекарственной терапии.
Первый шаг — иммунизация антителами животных (XIX в. – начало XX в.)
Ученых с давних пор интересовал вопрос о том, каким образом организм создает множество различных антител, обладающих уникальной специфичностью в отношении чужеродных веществ (антигенов), и каким образом эти антитела работают. Один из первых шагов к ответу на этот вопрос был сделан группой ученых, работавших в Институте инфекционных болезней в Берлине и открывших методы лечения дифтерии. В конце XIX века дифтерия у детей считалась смертельным неизлечимым заболеванием. Врач иммунолог-бактериолог Эмиль Беринг (Emil Behring) предположил, что лечение дифтерии может быть успешным в случае проявления естественной защитной реакции человеческого организма, а именно, если секретируемый дифтерийными бактериями токсин нейтрализовать. В 1890 г. Беринг совместно с японским ученым Сибасабуро Китасато установили, что неиммунизированные животные могут быть защищены от токсина дифтерийных бактерий с помощью инъекции антитоксина (антитоксической сыворотки) иммунизированных животных. В 1894 г. в период эпидемии дифтерии, унесшей жизни 50 000 детей в Германии, были произведены первые 25 000 доз антитоксина для применения в лечении людей. В 1901 г. Эмилю Берингу была присуждена Нобелевская премия за работу по сывороточной терапии. Однако на тот момент эффективность сыворотки была достаточно низкой, поскольку антитела в сыворотке вырабатывались клетками животных, а не самого пациента и вызывали лишь пассивный иммунитет. Антитоксин необходимо было вводить сразу после инфицирования, иначе было слишком поздно.
Еще одним примером использования антисыворотки в терапии людей стали исследования Чарльза Ричета (Charles Richet) и Жюля Эрикура (Jules Héricourt), применявших для лечения онкологических заболеваний антисыворотку, полученную путем иммунизации животных тканями саркомы. С середины 30-х годов практика пассивной иммунизации сошла на нет в связи с открытием антибиотиков широкого спектра действия.
Второй шаг — расшифровка структуры моноклональных антител (30–70-е гг. XX в.)
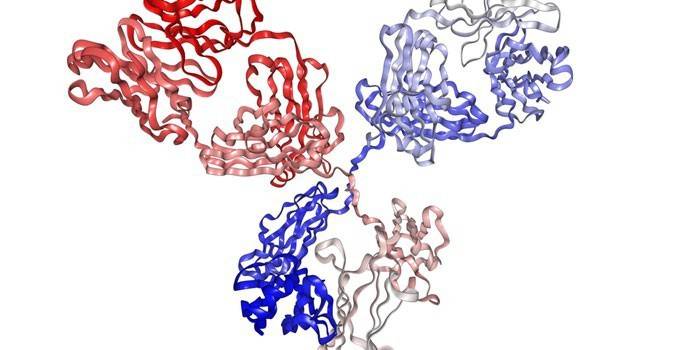
В 30-х гг. появились ультрацентрифуги, позволявшие разделять антитела по размеру и форме. В 40-х гг. ученые научились сортировать антитела по электрическому заряду и размеру. Однако дальнейшая расшифровка структуры антитела была пока недоступна из-за их большого размера, в 20 раз превышавшего размер молекул белков, структуры которых к тому времени уже были расшифрованы. Только в 1962 г. на базе многочисленных исследований, проводившихся различными учеными, Родни Портер (Rodney Porter) расшифровал основную структуру антител, стало известно, что антитело состоит из легкой и тяжелой цепи. Позже Родни Портеру совместно с Джеральдом Эдельманом (Gerald Edelman) удалось определить последовательность 1300 аминокислот, входящих в белковую цепь антитела, производимого клетками раковой опухоли миеломы. В то время это была самая большая расшифровка аминокислотной последовательности, за что в 1972 году ученые получили Нобелевскую премию. В результате исследований Портера и Эдельмана стало известно, что антитело имеет форму буквы Y, в которой нижняя часть (тяжелая цепь) имеет постоянную структуру для разных антител, а плечи (легкие цепи) значительно различаются у различных антител. Именно эти плечи отвечают за связывание антитела с антигеном и его нейтрализацию.
(Рисунок 1. Структура антитела, за которую ученые Родни Портер и Джеральд Эдельман в 1972 г. получили Нобелевскую премию по физиологии и медицине)
Третий шаг — разработка первой технологии синтеза антител (70–80-е гг. XX в.)
К 1970-м годам уже были известны некоторые важные моменты о том, каким образом в организме человека вырабатываются антитела. В частности, было известно, что за продуцирование антител отвечают В-лимфоциты, причем каждый В-лимфоцит может вырабатывать только одно специфическое антитело, при этом он редуплицируется и за счет этого быстро производит большое количество идентичных по структуре антител — так называемых моноклональных, то есть произошедших от одной клетки-предшественницы.
Добиться столь же быстрой выработки антител в лабораторных условиях удалось в 1975 году ученым Георгу Кёлеру (Georges Köhler) и Сезару Мильштейну (César Milstein). На тот момент была исследована способность клеток раковой опухоли миеломы быстро производить идентичные самим себе клетки. Кроме того, существовала возможность выделения антителопродуцирующих клеток из организма животных. Технология Кёлера и Мильштейна включала несколько этапов: у мыши вырабатывался иммунитет к известному антигену, затем из ее селезенки выделялись антителопродуцирующие клетки, эти клетки с помощью особой технологии соединялись с клетками миеломы с получением гибридомы, клетки которой непрерывно в большом количестве синтезировали антитела против известного антигена. Эта методика произвела переворот в изучении антител, поскольку позволила получать антитела с удивительно точным соответствием определенной структуре. В дальнейшем технология была усовершенствована, и в 1984 году Кёлер, Мильштейн и датский иммунолог Нильс Ерне (Niels Jerne) получили Нобелевскую премию за участие в создании антител, которые можно использовать для диагностических исследований и создания лекарственных средств. В дальнейшем было разработано множество технологий, позволивших усовершенствовать синтез антител за счет развития технологий рекомбинации ДНК, технологий клонирования клеток и других достижений генной инженерии.
Четвертый шаг — применение искусственно синтезированных антител для лечения заболеваний (80-е гг. XX в.)
При первых попытках применения для лечения людей антител, искусственно синтезированных из клеток животных, ученые столкнулись с трудностями. В 1979 г. впервые в мире ученые Филип Сташенко (Philip Stashenko) и Ли Надлер (Lee Nadler) применили искусственно синтезированные моноклональные антитела, полученные из клеток мышей, против антигенов, которые вырабатываются на поверхности клеток раковых опухолей. Однако было выявлено, что мышиные антитела в незначительной степени связывались с опухолевыми антигенами и воспринимались организмом как чужеродные клетки.
С 1986 г. на фармацевтическом рынке началась реализация препарата компании Janssen «Ортоклон ОКТ3» (муромонаб), который позволяет купировать реакцию отторжения трансплантата почки, оказывая избирательное иммуноподавляющее действие. Препарат имеет полностью мышиное происхождение, то есть синтезируется мышиными гибридомами, полученными слиянием мышиной миеломы и мышиных В-лимфоцитов. Вскоре после выхода препарата на рынок стало ясно, что при длительном применении мышиных моноклональных антител в качестве лекарственных средств их эффективность снижалась. Это связано с тем, что мышиные белки являются иммуногенными для организма человека, то есть воспринимаются как чужеродные объекты. В связи с этим у пациентов, которым вводят мышиные антитела, быстро образуются человеческие антимышиные антитела (human antimurine antibody – HAMA). Образующиеся HAMA-антитела нейтрализуют эффект мышиных антител.
Пятый шаг — создание химерных антител (90-е гг. XX в.)
В начале 90-х гг. с использованием молекулярно-биологических методов, основанных на применении рекомбинантной ДНК, были созданы химерные антитела. В химерных антителах часть «мышиной» молекулы с помощью методов генной инженерии заменялась на участок человеческого происхождения, а часть оставалась фрагментом мышиного происхождения. Поскольку белковая последовательность химерных антител на 75% состояла из «человеческих» последовательностей аминокислот, то у пациентов, получавших химерные антитела, HAMA-антитела образовывались в значительно меньшем количестве, и это сделало препараты на основе химерных антител значительно более эффективными, чем на основе мышиных. В дальнейшем был выпущен целый ряд лекарственных средств на основе химерных антител: ритуксимаб, выпускаемый под брендами «Мабтера» и «Ритуксан», — для лечения раковых опухолей, «Ремикейд» (инфликсимаб) — для лечения болезни Крона, «Симулект» (базиликсимаб) — для профилактики острого отторжения трансплантата почки, «Реопро» (абциксимаб) — для профилактики стенокардии и острого инфаркта миокарда, а также другие препараты.
Разработка химерных антител позволила практически полностью отказаться от использования мышиных антител. Однако в некоторых случаях использование мышиных антител и сегодня остается оправданным. Из одобренных к применению лекарственных средств сегодня лишь три являются мышиными: «Ортоклон-ОКТ3» (муромонаб-CD3), «Зевалин» (ибритумомаб тиуксетан) и «Бексар» (тозитумомаб-йод 131). Два последних являются радиоактивно мечеными мышиными МАТ. Их функция заключается в доставке радиоизотопов к клеткам лимфомы. Наличие радиоактивной метки позволяет применять эти антитела в очень небольших количествах, поэтому иммуногенность, обусловленная мышиными последовательностями, в этом случае не так значима. То, что эти препараты включают именно мышиные, а не гуманизированные или человеческие формы делает их более эффективными, потому что гуманизированные формы могли бы связываться одновременно не только с клетками-мишенями, но и со здоровыми клетками, нанося им вред. Также к применению сегодня одобрен один препарат на основе крысино-мышиного МАТ — это препарат «Ремоваб» (катумаксомаб) для лечения злокачественного асцита.
Шестой шаг — создание гуманизированных и человеческих моноклональных антител (конец 90-х гг. XX в. — 2000-е гг. XXI в.)
В конце 90-х гг. с помощью методов генной инженерии удалось свести к минимуму процент мышиных последовательностей аминокислот в искусственно синтезируемых антителах, благодаря чему были получены гуманизированные антитела, еще в меньше степени вызывающие образование HAMA-антител у человека. Начиная с конца 90-х гг. на рынок было выпущено множество препаратов на основе гуманизированных антител.
Примеры препаратов на основе моноклональных антител:
- «Зенапакс» (даклизумаб) — для профилактики отторжения после трансплантации почки,
- «Герцептин» (трастузумаб) — для лечения рака молочной железы и рака желудка,
- «Ксолар» (омализумаб) — для лечения атопической бронхиальной астмы и сезонного аллергического ринита,
- «Раптива» (эфализумаб) — для лечения псориаза, а также многие другие.
В 2000-х годах усовершенствованные методы генной инженерии наконец позволили добиться долгожданного результата и получить человеческие МАТ. В настоящее время человеческие МАТ чаще всего получают с помощью технологии трансгенных мышей (мышей, выведенных с использованием фрагментов чужеродной ДНК) или фагового дисплея (особый метод генной инженерии с использованием вирусов-бактериофагов). Например, сегодня для клинического применения одобрены такие препараты, созданные на основе человеческих МАТ, как «Бенлиста» (белимумаб) — для лечения красной волчанки, «Ервой» (ипилимумаб) — для лечения меланомы, «Симпони» (голимумаб) — для лечения ревматоидного артрита, псориатического артрита, болезни Бехтерева, а также другие препараты.
Еще один тип веществ, созданных методами генной инженерии для лечения пациентов, — это так называемые «белки слияния», в которых искусственно соединены два отдельных белка, зачастую с различными функциями. Например, на основе такого вещества создан препарат «Амевив» (алефацепт) моноклональные антитела при псориазе, орфанный препарат «Аркалист» (рилонацепт) — для лечения редких генетических аутовоспалительных заболеваний, относящихся к группе криопинсвязанных периодических синдромов, и другие препараты.
Разработка новых моноклональных антител сегодня
Разработка лекарственного средства с использованием моноклональных антител — это очень длительный и дорогостоящий процесс. Например, первый препарат на основе мышиных антител «Ортоклон OKT3» был зарегистрирован в 1986 г., только через 11 лет после того, как мышиные антитела были впервые описаны. Первый препарат на основе химерного МАТ «Реопро» был одобрен в 1994 г., через 10 лет после первых работ по изучению химерных МАТ. Первый препарат на основе гуманизированного МАТ «Зенапакс» был утвержден в 1997 г., через 11 лет после первого доклада о конструкции гена гуманизированного антитела. Препарат «Энбрел» на основе слитых белков был одобрен в 1998 г., через 10 лет после описания «белков слияния». Препарат «Хумира» на основе человеческих МАТ был одобрен в 2002 году, через 12 лет после первой статьи о подобных МАТ.
Сегодня интерес к разработке новых препаратов на основе моноклональных антител со стороны производителей очень высок. В настоящее время на территории Российской Федерации стадию клинических исследований проходит более 10 препаратов на основе МАТ. Общее количество препаратов, находящихся на стадии разработки в мире, исчисляется сотнями.
Перед современными учеными, исследующими моноклональные антитела, стоит множество актуальных задач. В частности, поиск решения проблемы иммуногенности препаратов, изготовленных на основе МАТ. Большинство препаратов на основе МАТ, которые сегодня проходят стадию клинических исследований, включают в состав человеческие антитела. Использование этого типа антител снизило иммуногенность препаратов, однако не устранило проблему полностью, поскольку иммунная система человека способна вырабатывать антитела против любого терапевтического белка.
Еще одна проблема, связанная с применением препаратов на основе моноклональных антител, обусловлена тем, что МАТ представляют собой крупные молекулы, которые не способны проникать внутрь клетки или глубоко в ткани. Сегодня МАТ нельзя применять внутрь, так как их концентрация для достижения эффекта должна в несколько тысяч раз превышать концентрацию молекул-мишеней. В связи с этими особенностями, сегодня ученые озабочены созданием нового поколения лекарственных средств, которые объединят в себе преимущества МАТ и мелкомолекулярных препаратов. На этом пути сделано уже несколько важных научных открытий. Первое из них — создание шведской компанией Affibody особых «аффител», которые обладают свойствами обычных антител, но имеют в десятки раз меньшую молекулярную массу, что позволяет им лучше проникать в ткани. Еще одно достижение науки — разработка «нанотел» бельгийской компанией Ablynx. Эти препараты характеризуются высокой стабильностью, что позволяет использовать их внутрь и местно. Кроме того, они просты в производстве. Сейчас на стадии клинических исследований у пациентов с тромбозами и остеопорозом находятся четыре «нанотела». Наконец, еще одно сверхсовременное направление — разработка доменовых антител американской компанией Domantis. Эти антитела должны соответствовать различным отделам тяжелой и легкой цепи антител человека и быть в десять раз меньше обычного антитела, что позволит применять их внутрь и ингаляционно.
Пока что длительность и высокая стоимость производства лекарственных средств с использованием моноклональных антител делает их не всегда доступными для пациентов. Однако ученые работают над созданием новых технологий, которые позволят выпускать новые препараты быстрее и по более низкой стоимости. Благодаря современным технологиям, уже сегодня многие препараты стали доступными для большого количества пациентов и позволили излечить заболевания, ранее считавшиеся неизлечимыми. Можно надеяться, что в будущем спектр излечимых заболеваний еще более расширится, а лекарственные средства на основе моноклональных антител станут еще более эффективными.
Номенклатура моноклональных антител
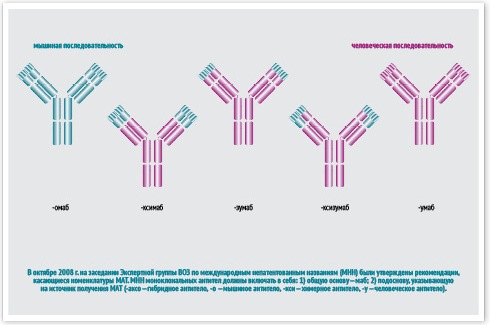
В октябре 2008 г. на заседании Экспертной группы ВОЗ по международным непатентованным названиям (МНН) были утверждены рекомендации, касающиеся номенклатуры МАТ. МНН моноклональных антител должны включать в себя:
- общую основу – маб;
- подоснову, указывающую на источник получения МАТ (-аксо — гибридное антитело, -о — мышиное антитело, -кси — химерное антитело, -у — человеческое антитело).
Моноклональные антитела (МАТ) – это антитела, произведенные в лабораторных условиях, которые имеют способность связываться с конкретными антигенами раковых клеток.
Например, белок, присутствующий на поверхности клеток рака, в здоровых клетках он не наблюдается или находится в минимальном количестве.
Система разработки моноклональных антител
Для создания моноклональных антител экспериментаторы вводят их грызунам с антигеном из человеческих раковых клеток. После этого они берут клетки, производящие антитела от животных и индивидуально соединяют их с раковой миеломной клеткой. Таким образом, получаются слитые клетки, известные под названием гибридомы.
Каждая отдельная гибридома (клеточная линия) путем деления далее производит дочерние идентичные клетки или клоны, которые и получили название «моноклональные».
Антитела, выдаваемые различными клонами, проходят проверку на способность идентифицировать такие антитела, которые намного теснее связаны с антигеном. При помощи этих гибридных бессмертных клеток можно получить большие количества антител.
Ввиду того, что мышиные антитела способны самостоятельно вызывать у людей иммунный ответ, который может снизить их эффективность, антитела мышей зачастую «очеловечивают» методом замены большей части родного антитела (человеческими порциями, насколько это возможно). Этот путь проделывается при помощи генной инженерии.
Механизм действия
 Каждая группа моноклональных антител работает по-своему. Некоторые препараты стимулируют иммунный ответ, разрушающий раковые клетки. Эти моноклональные антитела, равно как и антитела, полученные физиологическим путем работы В-клеток, покрывают поверхность раковой клетки оболочкой, тем самым вызывая разрушение ее иммунной системой.
Каждая группа моноклональных антител работает по-своему. Некоторые препараты стимулируют иммунный ответ, разрушающий раковые клетки. Эти моноклональные антитела, равно как и антитела, полученные физиологическим путем работы В-клеток, покрывают поверхность раковой клетки оболочкой, тем самым вызывая разрушение ее иммунной системой.
Медициной уже одобрены моноклональные антитела этого типа. Например, ритуксимаб – препарат ориентирован на антиген CD20, обнаруженный в клетках неходжкинской лимфомы, или алемтузумаб, ориентированный на антиген CD52, который был найден в клетках ХЛЛ (хронического лимфолейкоза).
Ритуксимаб способен непосредственно являться причиной гибели клеток (апоптоз). Другая группа препаратов моноклональных антител, связываясь с рецепторами находящимися на поверхности клеток иммунной системы, стимулирует противоопухолевый иммунный ответ и уменьшает сигналы, мешающие иммунным клеткам нападать на ткани собственного организма, в число которых входят и раковые клетки.
Ипилимумаб, относящийся к группе подобных препаратов, был создан сравнительно недавно в 2011 году для лечения метастатической меланомы. Существуют и другие аналогичные лекарства, но они еще находятся в стадии клинических исследований.
Антитела мешают деятельности белков (VEGF), необходимых для роста раковой опухоли. Например, действие препарата бевацизумаб направлено на эндотелиальный сосудистый фактор роста белка, выделяемого опухолевыми и другими клетками, находящимися в микроокружении опухоли (это способствует разветвлению кровеносных сосудов, питающих злокачественную опухоль).
В тот момент, когда бевацизумаб связывается с VEGF, белок теряет способность взаимодействовать с клеточными рецепторами, что предотвращает рост новых кровеносных сосудов.
По такой же аналогии действуют препараты панитумумаб и цетуксимаб. В данном случае целевым выступает EGFR (рецептор эпидермального фактора и роста), а моноклональные антитела трастузумаб настроены на HER-2 (человеческий рецептор эпидермального фактора роста 2).
МАТ, связывающиеся с клеточной основой фактора роста рецепторов, мешают рецептору отправлять свои нормальные, вызывающие рост, сигналы. Кроме того они могут активизировать иммунную систему и запускать апоптоз для уничтожения опухолевых клеток.
К другой группе противоопухолевых терапевтических моноклональных антител относятся иммуноконъюгаты. Их иногда называют антитела конъюгаты или иммунотоксины – эти препараты объединяют в своем составе:
- химиотерапевтические препараты;
- бактериальные токсины;
- радиоактивные молекулы, прикрепленные к веществу клеток киллеров.
Прикрепляется антитело на поверхности раковой клетки к своему специфическому антигену, и в ту же минуту действующее вещество начинает растворять раковые клетки. Работающие таким образом и утвержденные иммуноконъюгаты – это, прежде всего:
- ибритумомаб тиуксетан, действие которого направлено на антиген CD20. Препарат ориентирован на доставку радиоактивного иттрия-90 к В-клеткам, что необходимо для устранения неходжкинской лимфомы;
- шума-трастузумаб эмтансин, ориентированный на молекулу HER-2. МАТ нужен для доставки препарата DM1, ингибитора пролиферации клеток. HER-2 относится к метастатическим клеткам онкологии молочной железы;
- тозитумомаб, ориентированный на антиген CD20 для доставки радиоактивного йода-131 к клеткам неходжкинской лимфомы.
Сфера применения и стоимость
Цена на моноклональные антитела по мере роста их производства будет уменьшаться. Все описанное выше довольно сложно. Однако наука не стоит на месте, а высокими темпами движется вперед. Поэтому сегодня моноклональные антитела являются эффективным средством для борьбы с раком и находят широкое применение в других направлениях медицины.
 Ввиду важности исследований, проведенных для создания моноклональных препаратов, в работу были вовлечены ведущие фармацевтические компании всего мира. Сегодня МАТ – основное направление разработок по борьбе с раком.
Ввиду важности исследований, проведенных для создания моноклональных препаратов, в работу были вовлечены ведущие фармацевтические компании всего мира. Сегодня МАТ – основное направление разработок по борьбе с раком.
Вполне естественно, что цена на препараты сегодня далека для массового использования. Но в перспективе планируется уменьшение себестоимости МАТ, что значительно скажется на понижении цены в розничной торговле. Например, с препаратом ипилимумаб это уже произошло.
Препарат Ипилимумаб (его аптечное название Ервой — Yervoy) создан для лечения прогрессирующих стадий рака щитовидной железы, простаты, кожи и некоторых других видов раковых опухолей. Несмотря на то, что на рынке препарат появился совсем недавно (2011 г.), он успел себя проявить как результативное средство в борьбе с поздними стадиями меланомы.
Использование препарата (по данным статистики) позволило сократить смертность среди пациентов на 50%. Следует отметить, что меланома в прогрессирующей стадии ранее не поддавалась лечению. Не удивительно, что сегодня стоимость препарата еще очень далека от возможности широкого применения:
- Ипилимумаб 5мг/мл – 1 упаковка 10 мл, стоимость вместе с доставкой из Германии в Москву – 4650 €.
- Ипилимумаб 5мг/мл – 1 упаковка 40 мл, стоимость вместе с доставкой из Германии в Москву – 17 500 €.
Поставщик гарантирует своевременную доставку и подтверждение покупки в аптеке Германии всеми документами и сертификатами.
Препарат Бевацизумаб (действующее вещество бевацизумаб, аптечное название Авастин) – раствор для инъекций от 17000 руб. за 25 мл. МАТ обладает довольно узкой направленностью – метастатический колоректальный рак. Нередко лекарство назначают в комплексе с химиотерапией, основанной на агенте фторпиримидина и его производных.
Важно! Авастин хорошо проявил себя в офтальмологии. Препарат широко использует Московская Глазная Клиника. Ввиду того, что моноклональные антитела успешно применяются для лечения такого «тонкого аппарата» как глаз, результатам клинических испытаний вполне можно доверять и назначатьМАТ для избавления от онкологии.
Конечно, для офтальмологических целей препараты готовят с некоторым отличием, поэтому и стоимость глазного Авастина будет другой, чем цена концентрата для инфузивного использовании при лечении онкологических заболеваний.
Препарат моноклональных антител Цетуксимаб (другое название Эрбитукс, действующий компонент цетуксимаб). Стоимость упаковки (5 мг/мл) от 8500 руб. Направленность – злокачественные опухоли головного мозга, лица и шеи. К этим заболеваниям можно добавить рак толстого кишечника и онкологии, имеющие другую локализацию, но непременно вторичный рак.
Применение МАТ при ревматоидном артрите
Среди пациентов страдающих ревматоидным артритом данная методика лечения нашла широкое применение. Моноклональные антитела весьма эффективны в тех случаях, где другие препараты не оказали терапевтического действия.
В странах Европы на сегодняшний день основным терапевтическим направлением при ревматоидном артрите являются именно моноклональные антитела. В этом плане используется Метотрексат. Если состояние пациента не улучшается, назначают моноклональные препараты с направленностью к В-лимфоцитам.
 Терапевтический курс при артрите довольно длительный, так как моноклональные антитела действуют достаточно медленно.
Терапевтический курс при артрите довольно длительный, так как моноклональные антитела действуют достаточно медленно.
Принимается во внимание и тот факт, что диагностировать ревматоидный артрит очень сложно. Сегодня ни один биохимический анализ крови при ревматоидном артрите или тест не может дать абсолютно точного результата, указывающего на присутствие у пациента именно ревматоидного артрита, а не другого схожего заболевания.
Поэтому к ревматологу за помощью следует обращаться как можно раньше, при первых симптомах и подозрениях на артрит.
Над созданием моноклональных препаратов трудились ученые многих стран. Действие этих лекарств невозможно сопоставить с другими медицинскими препаратами от ревматоидного артрита, существующими на сегодняшний день.
Их первостепенная задача – определение конкретного антигена. Все моноклональные лекарства принадлежат к иммуноглобулиновому классу. Они точно выявляют антитела и вызывают на себя иммунную реакцию. Для совершенствования методик лечения ревматоидного артрита фармакологи всего мира постоянно проводят в этой области научные исследования.
Уже сегодня на практике введено использование гуманизированных антител – новый вид антител, имеющий отношение к моноклональным, к рецептору интерлейкина-6. Его применение отмечает уменьшение у пациентов симптомов воспалительных процессов в суставах.
Лекарства можно комбинировать с другими препаратами, изменяющими течение болезни. Эта группа медикаментов останавливает разрушительный процесс, происходящий в суставах при ревматоидном артрите.